כוחות בין מולקולריים
המעבר ממוצק לנוזל וכן מנוזל לגז, הוא תהליך הנקרא מעבר פאזה. יש להשקיע אנרגיה כדי להתגבר על כוחות המשיכה בין החלקיקים ולהרחיקם זה מזה.
ככל שהקשרים הבין מולקולריים חזקים יותר, נדרשת אנרגיה רבה יותר כדי לגרום למעבר הפאזה ולכן טמפרטורות ההיתוך והרתיחה תהיינה גבוהות יותר.
חשוב להדגיש כי כוחות בין מולקולריים אלו הם כוחות שפועלים בין המולקולות ולא הכוחות של הקשרים היוניים והקוולנטיים שמחזיקים את המולקולה ביחד.
נדון בשלושה סוגים שונים של כוחות בין מולקולריים:
כוחות דיפול-דיפול
בין דיפולים (כלומר בין מולקולות קוטביות) קיים כוח משיכה חלש הנקרא כוח ון דר ואלס, הגורם לדיפולים אלה להיות קרובים זה לזה (משיכה אלקטרוסטטית).
ככל שהמולקולות פולריות יותר כך גדל כוח המשיכה מסוג ון-דר-ולס.
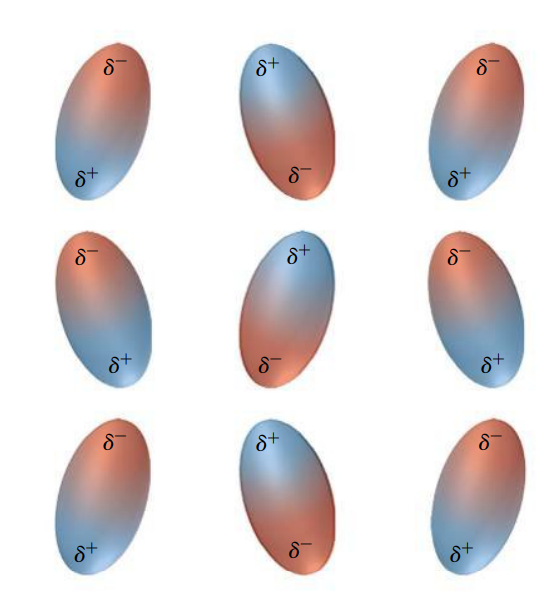
זו הסיבה שטמפרטורת הרתיחה של חומר פולרי גבוהה יותר מאשר של חומר לא פולרי.

דיפול מושרה
כוחות משיכה יכולים להתקיים גם בין מולקולות לא פולריות וגם בין אטומים - הליום למשל, מתנזל (הופך לנוזל) בטמפ’ של
כאשר שני חלקיקים לא פולריים מתקרבים זה לזה, הדחייה בין ענני האלקטורים שלהם גורמת להיווצרותו של דיפול מושרה, מעין קיטוב רגעי.
נתבונן באיור הבא:
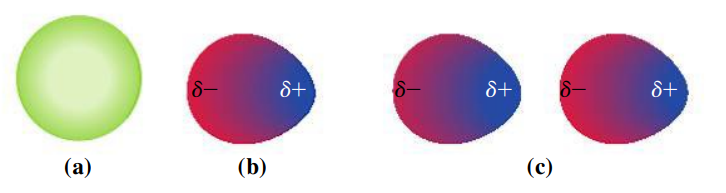
במצב רגיל (
בין הדיפולים המושרים הללו, אנו קוראים לכוחות משיכה כוחות דיספרסיה (או כוחות לונדון) והם למעשה מקרה פרטי של כוחות ון-דר-ואלס (כוחות ון-דר-ואלס הוא שם כללי לכוחות שקושרים בין מולקולות).
חוזק כוחות הדיפול המושרה תלוי בשני גורמים:
- מידת הפולריזביליות של האטום/מולקולה, כלומר, מידת הנטייה של פיזור המטען לחרוג מצורתה הרגילה. הפולריזביליות תלויה בגודל החלקיק, כלומר בגודל ענן האלקטרון מסביב לחלקיק, שהוא בעצמו תלוי בערך במסה שלו:
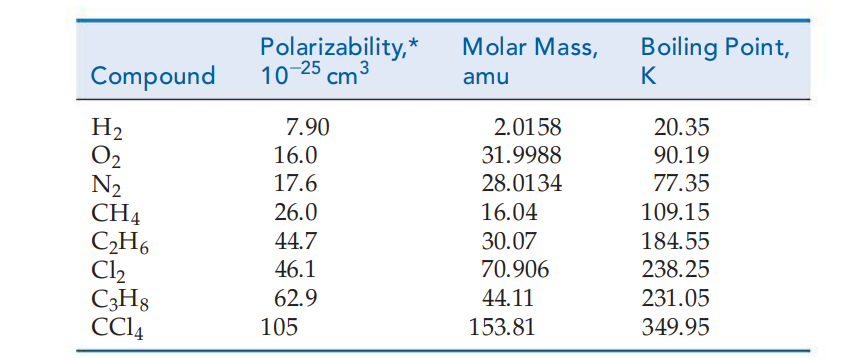
עבור מולקולות לא פולאריות (או אטומים), טמפרטורת הרתיחה פרופורציונית למסה המולקולרית/אטומית.
- המבנה המרחבי של מולקולות בעלות מסות דומות. קל יותר לאלקטרונים במולקולות ארוכות “להיעקר” מאשר לאלקטרונים במולקולות קטנות, קומפקטיות וסימטריות. המולקולות הארוכות הן יותר פולרזיביות. שני חומרים בעלי מספר וסוג אטומים זהים, אבל מבנים מולקולריים שונים (איזומרים) יכולים להיות בעלי מאפיינים שונים:

למרות שכוחות ון-דר-ולס, ובמיוחד כוחות דיספרסיה, הם כוחות חלשים (תלות חוזק הכוח במרחק פרופורציוני ל:
כוחות מימן
טמפרטורת הרתיחה של מולקולות המכילות מימן בנוסף לאטום חמצן, פואור, או חנקן (אטומי
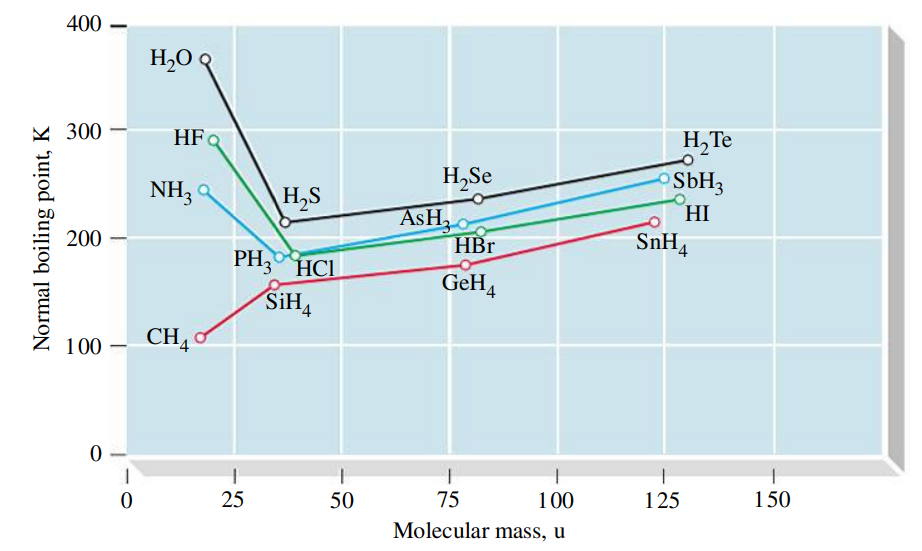
הקשר הקוולנטי בין אטום המימן לכל אחד מאטומים הללו (
מדוע? ניקח למשל את
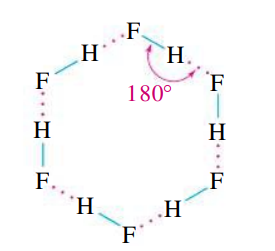
- הדיפולים של
- למרות שאטום ה-
קשר זה נקרא קשר מימן, בו אטום
מעברי פאזה
אידוי ועיבוי
נביט במים בכלי:
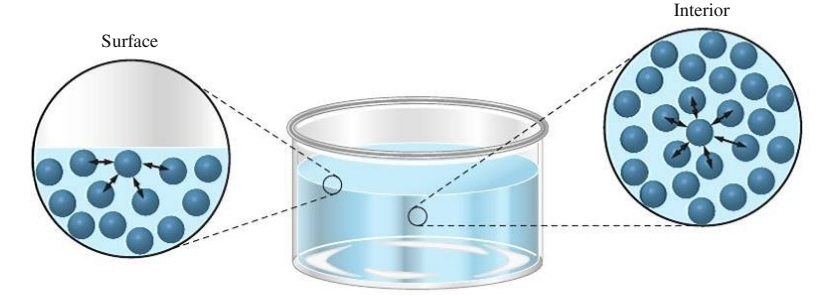
בפני שטח הנוזל, הכוח הפועל על המולקולות הוא אך ורק כוחות בין מולקולריים בין מולקולות לצידו ומולקולות מתחתיו. לעומת זאת, מולקולות בחלק הפנימי חשות כוחות מכל כיוון. לכן, קיים הבדל אנרגטי בין מולקולות הנמצאות על פני השטח של הנוזל לבין כאלה הנמצאות בתוך הכלי - המולקולות הפנימיות מרגישות יותר כוחות משיכה אחת לשנייה מאשר המולקולות בפני השטח, ולכן נמצאות באנרגיה יותר נמוכה.
אם נוסיף אנרגיה למולקולה בפני שטח הנוזל, אז הוספת אנרגיה זו עלולה להביא לשחרורו מפני השטח. כלומר אם למולקולות בכלי אנרגיה קינטית גבוהה מבפיק בכדי להתגבר על כוחות המשיכה הבין מולקולריים, יעזבו מולקולת אלה את פאזת הנוזל ויעברו לפאזה הגזית.
תהליך זה נקרא אידוי.
את האנרגיה הדרושה לאידוי מול של חומר מסוים נסמן
תהליך זה הוא אנדותרמי - הוא “סופג” חום על מנת לעבור למצב צבירה גזי. לכן כדי שתהליך האידוי ימשיך, יש צורך בהמשך העברת חום אל הנוזל.
קצב האידוי יגדל כאשר:
- הטמפרטורה תעלה
- פני שטח הנוזל יגדל
- הכוחות הבין מולקולרים ייחלשו (ואז נצטרך פחות אנרגיה כדי להעביר את המולקולות לפאזה גזית).
התהליך ההפוך - בו חומר בפאזה גזית עובר לפאזה נוזלית, נקרא עיבוי. האנרגיה שהמולקולות מאבדות נפלטת לסביבה, ולכן זהו תהליך אקסותרמי:
כיוון שאידוי ועיבוי הם תהליכים הפוכים, אז:
לחץ אדים
נאמר כי מערכת סגורה של נוזל מגיע לשיווי משקל דינמי כאשר קצב אידוי הנוזל משתווה לקצב העיבוי שלו:
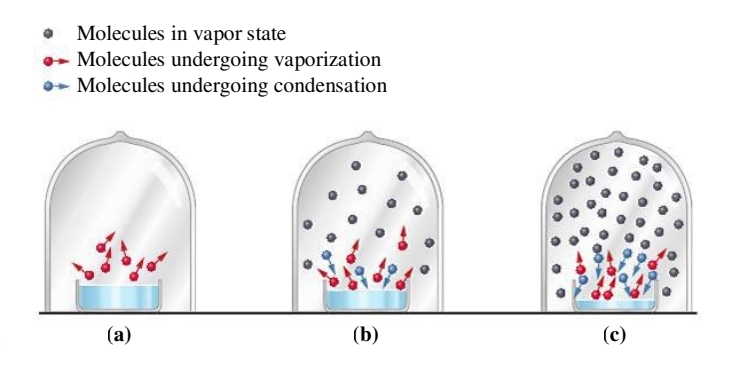
את שיווי משקל זה נהוג לסמן כך:
הלחץ שמופעל ע”י האדים בשיווי משקל זה נקרא לחץ אדים. לחץ זה תלוי רק בסוג הנוזל ובטמפרטורה שלו - לא בכמות הנוזל או האדים, כל עוד יש קצת מכל אחת בשיווי משקל.
ככל שהטמפרטורה עולה, כך קצב האידוי גדל, ולכן יידרש לחץ אדים יותר גבוה כדי שקצב העיבוי ישתווה לקצב האידוי החדש, ולכן לחץ האדים גדל:
ככל שהטמפרטורה עולה, לחץ האדים גדל.
משוואת קלאוזיוס-קלפירון
את התלות הזאת של לחץ האדים בטמפרטורה ניתן לתאר ע”י המשוואה:
כאשר
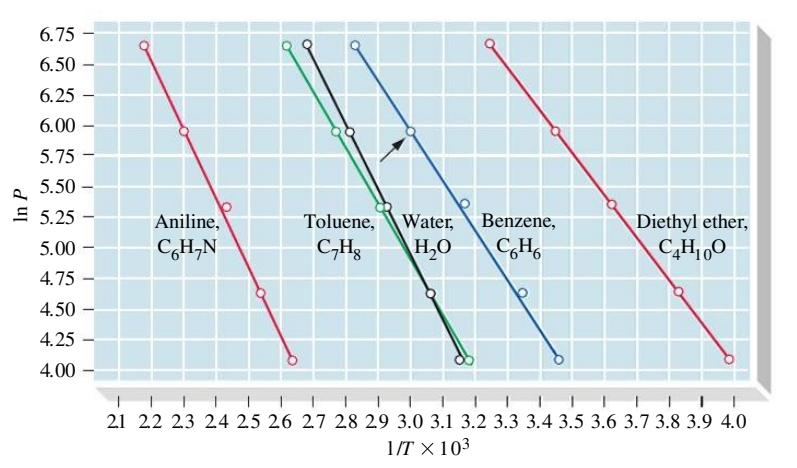
מכיוון שלא ניתן לדעת את הערך של
רתיחה
ככל שמחממים נוזל מסוים, האנרגיה הקינטית של החלקיקים שלו עולה. תהליך האידוי מתרחש יותר ויותר מהר, ויותר מולקולות יכולות “לברוח” לפאזת הגז. בשלב מסוים, לכל הנוזל יש מספיק אנרגיה קינטית להתאדות.
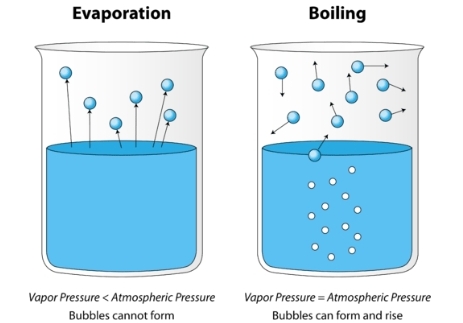
במצב זה, מתחילים להיווצר בועות אדים בכל הנוזל עד שהלחץ שלהם עולה ומשתווה ללחץ מחוץ לכלי. כיוון שהלחץ של הבועות שווה ללחץ החיצוני, הן עולות לפני שטח הנוזל ו”בורחות” אל האטמוספרה. אנו קוראים לטמפטורה הזאת נקודת הרתיחה של הנוזל, והיא כאמור תלויה בלחץ החיצוני. לתהליך זה אנו קוראים רתיחה.
חשוב לזכור:
לחץ אדים של נוזל ברתיחה שווה ללחץ החיצוני.
כיוון שנקודת הרתיחה של נוזל תלויה בלחץ החיצוני, נקבל שנוזל מסוים ירתח בטמפרטורות שונות אם הלחץ האטמוספרי שונה.
דוגמאות:
- העיר דנוור נמאת בגובה
מעל פני הים. לחץ האוויר בעיר הוא . באיזו טמפרטורה רותחים מים בדנוור? נתון: אנתלפיית הרתיחה של מים היא .
פתרון:
לפי הנתונים נסמן:לפי משוואת קלאוזיוס - קלפירון:
הערות:
- הטמפרטורה בה לחץ האדים של חומר נתון שווה ל-
נקראת טמפרטורת/נקודת הרתיחה הנורמלית של החומר.
בזמן הרתיחה, כל יחידת חום שמתווספת לנוזל מושקעת בפירוק הקשרים הבין מולקולריים בנוזל ולכן הטמפרטורה נשארת קבועה בתהליך זה.
מעברי פאזה שונים - היתוך, קיפאון, המראה, שיקוע
קיפאון/התכה
קיפאון והתכה מתחייסים לשינוי מצב הצבירה בין מוצק ונוזל. באופן דומה לתהליך האידוי והעיבוי:
תהליך ההיתוך הוא אנדותרמי:
תהליך הקיפאון הוא אקסותרמי:
כאשר מתקיים:
באופן זהה לתהליך הרתיחה, בזמן ההיתוך (כלומר בזמן מעבר הפאזה) כל יחידת חום שונה שמתווספת למערכת “מנוצלת” לשבירת הקשרים הבין מולקולריים, ולכן טמפרטורת המוצק אינה עולה:
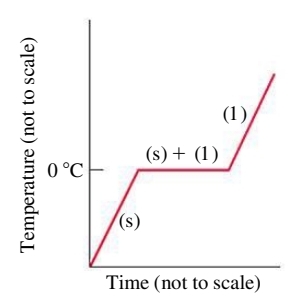
לעומת אידוי, לא ניתן לחשב ע”י משוואת קלאוזיוס-קליפרון את חום ההיתוך/קיפאון (לפחות לא בצורה ישירה).
המראה/שיקוע
מעבר ישיר ממוצק לגז מבלי לעבור דרך פאזה נוזלית נקרא המראה. התהליך ההפוך נקרא שיקוע. תופעה זו מתרחשת הודות ללחץ החיצוני הנמוך המופעל על החומר. לכל חומר קיים טווח המראה כפונקצייה של הטמפרטורה, אך יחסית מעט חומרים עוברים המראה בלחץ של אטמוספרה אחת.
תהליך ההמראה הוא אנדותרמי:
תהליך השיקוע הוא אקסותרמי:
כאשר מתקיים:
בעזרת משוואת קלאוזיוס-קליפרון ניתן לחשב את לחץ האדים/ההמראה של מוצק:
ובקירוב טוב, עבור שלושת מצבי הצבירה מתקיים הקשר הבא:
דיאגרמת פאזות
דיאגרמת פאזות היא דיאגרמה המתארת את מצב הצבירה של חומר נתון פונקציה של טמפרטורה ולחץ חיצוניים - דיאגרמת לחץ - טמפרטורה.
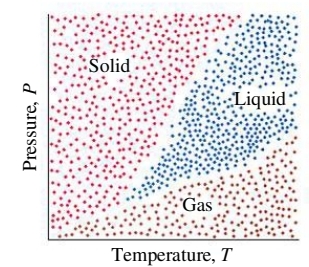
בטמפרטורות נמוכות ולחץ גבוה, כמו בנקודות האדומות בגרף, נצפה שאטומים, יונים או מולקולות של חומר להיות קרובות אחת לשנייה בצורה מסודרת - מוצק.
בטמפרטורות גבוהות ולחץ נמוך, הנקודות החומות, נצפה לפאזה גזית.
כל מה שבינהם, נצפה שיהיה נוזל.
הקווים הלבנים (הריקים מנקודות), מציינים מצב של שיווי משקל בין שתי פאזות, ואלה הן בעצם הנקודות הרתיחה/עיבוי, המראה/שיקוע, היתוך/הקפאה. משוואת קלאוזיוס קליפרון יודעת לתת לנו כל שתי נקודות על קווים לבנים אלו.
נביט בדיאגרמת פאזות של יוד:
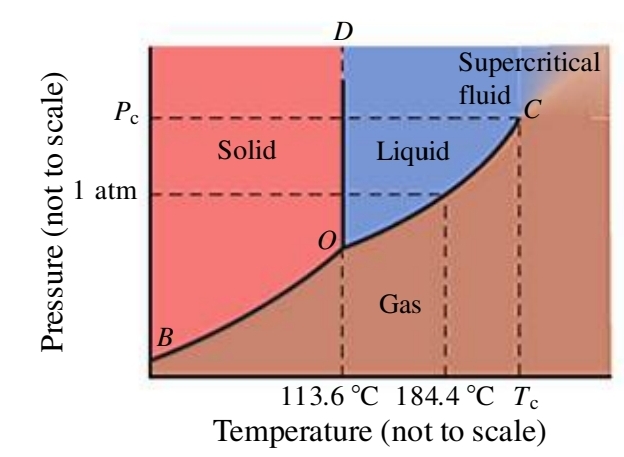
הנקודה
הנקודה

