שיווי משקל כימי
עד כה, תיארנו תגובות כימיות חד כיווניות, כאשר רעיון הסטויכיומטריות עזר לנו לחשב את כמות התוצרים. אבל, ישנם תגובות שהן דו-צדדיות, כלומר מתרחשות בשני הכיוונים בו זמנית, באותו הקצב. ניתן דוגמה לתהליך פיזיקלי שמתרחש בשני הכיוונים:
- כאשר נוזל מתאדה בכלי סגור, לאחר זמן, האדים מתחילים להתעבות בחזרה אל הנוזל באותו קצב שבו הנוזל מתאדה. למרות שמולקולות ממשיכות לעבור בין פאזה גזית לפאזה נוזלית (תהליך דינמי), הלחץ שמופעל ע”י האדים נשאר קבוע - זהו לחץ אדים.
תהליכים מסוג זה זה נקראים תהליכים בשיווי משקל, ודוגמה זו ספציפית היא דוגמה לשיווי משקל דינמי, כלומר גם אחרי שהמערכת הגיעה לשיווי משקל, התהליכים המנוגדים ממשיכים לקרות (הנוזל כל הזמן מתאדה והגז כל הזמן מתעבה).
ש”מ מתקיים גם עבור תגובות כימיות הפיכות - תגובות אשר עשויות להתרחש בשני כיוונים (מגיבים לתוצרים או תוצרים למגיבין) בהתאם לתנאי המערכת.
תגובה כימית מוגדרת כתגובת שיווי משקל כאשר ריכוזי המגיבים והתוצרים איננו משתנה בזמן.
מאפייני שיווי משקל כימי:
- שיווי המשקל מתקבל רק במערכת סגורה.
- הריכוז של כל אחד ממרכיבי המערכת קבוע.
- המערכת דינאמית והפיכה - מגיבים הופכים לתוצרים ותוצרים למגיבים בקצב שווה.
- ניתן להגיע לאותו מצב של שיווי משקל בתנאי התחלה שונים (כלומר ריכוזי מגיבים או תוצרים שונים).
הערה חשובה:
התגובות שראינו עד עכשיו, כאלה שמתוארות ע”י חץ בכיוון אחד, נקראות תגובות סטויכיומטריות. בתגובות אלה, כמות התוצרים נקבעת על סמך סטויכיומטריית התגובה. למשל, בתגובת השריפה של גז הבישול פרופאן:
אם נכניס מול אחד של פרופאן לכל התגובה, נקבל
מולים של פחמן דו-חמצני ו- מולים של מים (בהנחה שכמות החמצן אינה מוגבלת).
לעומת זאת, בתגובת שיווי משקל, כמו יצירת אמוניה:אם נכניס מול אחד של גז חנקן לכל התגובה, לא נוכל לדעת על סמך הסטויכיומטריה בלבד מה תהיה כמות האמוניה שתיווצר, כי לאחר זמן מסוים, הקצב בו האמוניה מתפרקת בכיוון השני ישתווה לקצב בו היא תיווצר. כפי שנראה בהמשך גורם אחר קובע את כמות התוצר בתגובות ש”מ.
הסטויכיומטריה משפיעה על קביעת הכמות אך היא לא הגורם היחיד.
דוגמאות:
- נסתכל על התגובה ליצירת מתנול (
) מהגזים ו- :
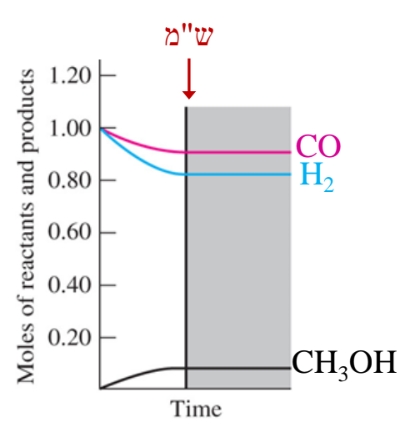
כאשר נכניס לכליו- (מגיבים), ייווצר בכלי (תוצר). אם נעקוב אחר ריכוזי החומרים (כולם בפאזה הגזית) לאורך הזמן, נקבל את הגרף הבא:
- כמות המגיבים יורדת וכמות התוצרים עולה עם הזמן וכאשר מושג ש”מ אין עוד שינוי בכמויות החומרים בכלי.
- ניתן לראות כי קצב השינוי בכמויות החומרים מהיר בהתחלה ואח”כ הולף ויורד עד להתאפסות בש”מ.
ניתן לראות כי צריכה של כמות כפולה שלביחס ל- , ואילו כמות ה- הנוצרת זהה לכמות ה- שמגיבה. לכן: כאשר נכניס לכלי רק מגיבים ברור כי התגבוה תתקדים לכיוון התוצרים. אך מה יקרה כשנכניס לכלי רק תוצרים או תערובת של מגיבים ותוצרים?
מסקנה:
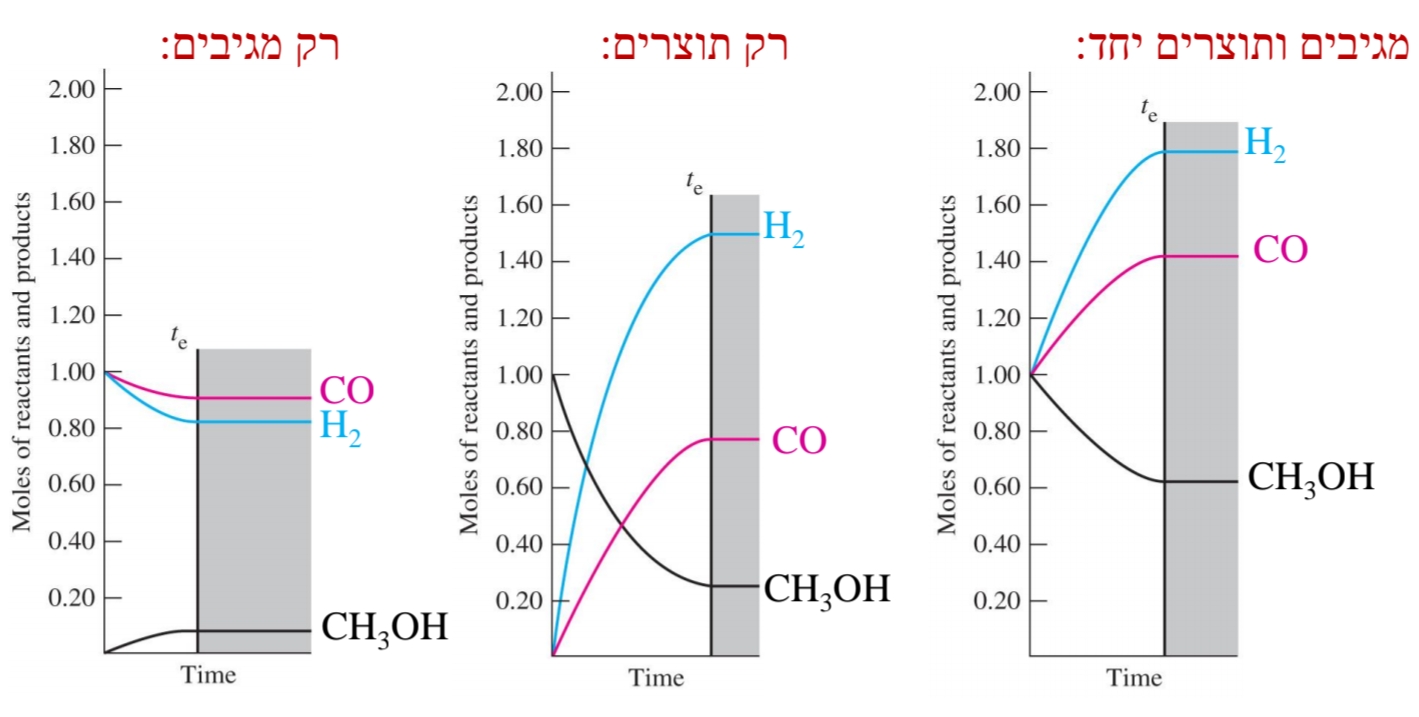
- במצב ש”מ נוכחים בכלי כל החומרים המשתתפים בתגובה.
- כמות החומרים בש”ם שונה כאשר תנאי ההתחלה שונים.
שאלות:
- אם התגובה היא דו-צדדית, מה המשמעות של “מגיבים” ו-”תוצרים”?
תשובה: זוהי צורה פשוטה להבדיל בין הצד השמאלי לצד הימני של התגובה. אין באמת הפרדה בין מגיבים לתוצרים, הרי כל החומרים בתגובה הם שניהם. בהמשך נראה כי החלפת הצדדים של המשוואה הכימית אמנם הופכת את הקבוע בו אנו נעזרים כדי לדעת מהו ריכוזי החומרים בש”מ, אבל היא לא מתארת שינוי משמעותי לגבי מה שבאמת קורה.- כיצד ניתן לדעת את ריכוזי החומרים בש”מ?
תשובה: קבוע שווי משקל.- כאשר מתחילים את התגובה מתערובת של כל המרכיבים בה (גם תוצרים וגם מגיבים), האם נוכל לצפות את כיוון התקדמות התגובה?
תשובה: מנת התגובה.
קבוע שווי משקל
קבוע שווי משקל לפי ריכוזים
עבור תגובה כימית כללית הנמצאת בש”מ:
קבוע ש”מ לפי ריכוזים (
הערות:
- ערכו של קבוע ש”מ משתנה רק כאשר משנים את טמפרטורת התגובה!
- לפי ההגדרה שנתנו, ניתן יהיה להסיק כי לקבוע ש”מ יש יחידות, בהתאם למקדמים הטויכיומטרים, כלומר יחידות שונות בין תגובות שונות. אבל, אם נחלק את ריכוזו של כל חומר בריכוז סטנדרטי של
, כלומר נבטל את היחידות, אז נקבל קבוע חסר יחידות. כלומר, בתאכלס, כאשר אנחנו מציבים את הריכוזים בנוסחא, עלינו להציב אותם ללא יחידות. נוסחה יותר כללית ונכונה תהיה: כאשר
הוא ו- הוא היחידות:
דוגמאות:
- עבור התגובה:
הקבוע:
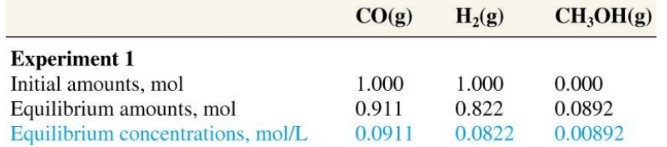
- עבור הדוגמא הקודמת של התגובה הכימית הבאה:
והנתונים הבאים:
נתון לנו גם הריכוזים לאחר שהגיע לשיווי משקל ולכן נוכל להגיע לתוצאה מספרית:
שיווי משקל הטרוגני
לגבי התגובה הבאה:
נשים לב ששניים ממשתתפי התגובה במצב מוצק ואחד במצב גז. כאשר בתגובת שיווי משקל מופיעים יותר ממצב צבירה אחד, נקרא לשווי משקל זה שיווי משקל הטרוגני.
נוזלים או מוצקים טהורים המשתתפים בתגובה אינם מופיעים בביטוי של קבוע ש”מ, שכן ריכוזם אינו משתנה במהלך התגובה - רק גזים או חומרים מומסים מופיעים בקבוע ש”מ.
ולכן:
הערות:
- חשוב להבין כי נוזלים/מוצקים אמנם אינם באים לידי ביטוי בקבוע ש”מ, אך הם חייבים להיות נוכחים בכלי על מנת שהתגובה בשיווי המשקל תתקיים.
קבוע שיווי משקל לפי לחצים חלקיים
עבור תגובה כימית כללית הנמצאת בש”מ:
קבוע ש”מ לפי לחצים חלקיים (
הערות:
- בדומה לקבוע ש”מ לפי ריכוזים, גם יחידוציו של קבוע ש”מ לפי לחצים חלקיים תהייה תלויות במקדמים הסטויכיומטריים של תגובה נתונה. ובדומה ל-
, ניתן יהיה לחלק את הלחץ החלקי של כל משתתף בתגובה בלחץ סטנדרטי של וכף לקבל קבוע ש”מ לפי לחצים חלקיים חסר יחידות.
משמעותו של גודלו של קבוע ש”מ
- כאשר
- כאשר
כללים בטיפול בקבוע שווי משקל
תהי תגובה כימית כללית:
- כאשר מכפילים את המקדמים הסטויכיומטריים של תגובה נתונה בקבוע כלשהו:
- כאשר הופכים תגובה כימית:
- כאשר סוכמים שתי תגובות:
מנת התגובה
עבור תגובה כימית כללית:
ניתן לחשב את מנת התגובה (לפי ריכוזים
כאשר נשווה את
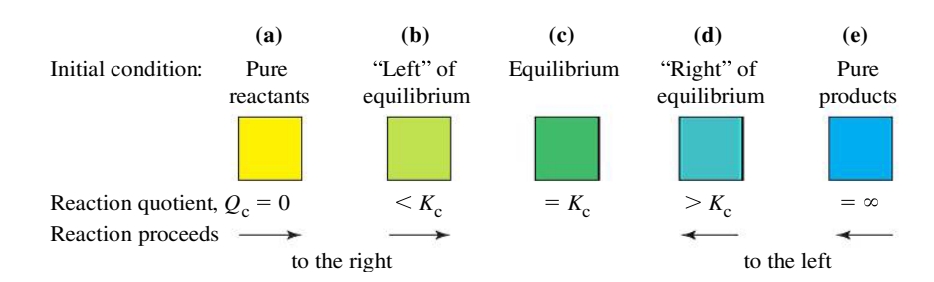
כלומר:
- אם
- אם
- אם
דוגמאות:
- נחזור לדוגמתנו של התגובה:
לאיזה כיוון תתקדם התגובה כאשר נערבב מול אחד מכל האחד מהמרכיבים (גם מגיבים וגם תוצרים) בכלי בנפח
? מתקיים
ולכן התגובה תתקדם שמאלה, לכיוון המגיבים.
עיקרון לה שטלייה
הכימאי הצרפתי אנרי לה שטלייה קבע את העיקרון הבא:
כאשר מערכת בש”מ נתונה לשינוי בטמפרטורה, לחץ או ריכוז המגיבים, המערכת מגיבה ע”י השגת ש”מ חדש שמשנה חלקית את מידת השינוי.
שינוי ריכוז
נתבונן למשל בתגובה:
נניח והתחלנו עם כמות בש”מ של
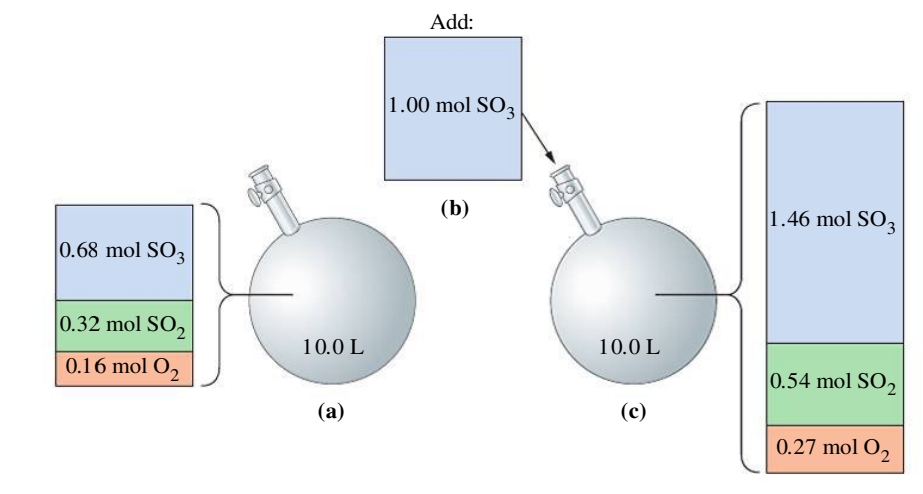
לפי לה שטלייה, התגובה תתקדם בכיוון שיפחית את כמותו של החומר שהוסף. במקרה זה התווסף תוצר, לכן התגובה תתקדם לכיוון המגיבים.
נשים לב כי
שינוי לחץ
ישנן שלושה דרכים לשנות את הלחץ של מערכת בטמפרטורה קבועה וש”מ:
- להוסיף או להסיר מגיב גזי. פעולה זו היא פשוט הוספה או החסרה של גז כמו שראינו בשינוי ריכוז.
- הופסה של גז אינרטי לתערובת כימית בכלי קבוע נפח. פעולה זו לא משנה את הש”מ מהסיבה שאומנם הלחץ הכללי גדל, אבל הלחצים החלקיים לא משתנים כי הם מחושבים לפי כלל הלחצים שמשתתפים בתגובה - גזים אינרטים לא משתתפים בתגובה.
- שינוי הלחץ ע”י שינוי הנפח של מערכת. הקטנת הנפח של מערכת מגדילה את הלחץ, והגדלת נפח של מערכת מקטינה את הלחץ.
נתבונן באותה תגובה כאשר נשנה את הנפח:
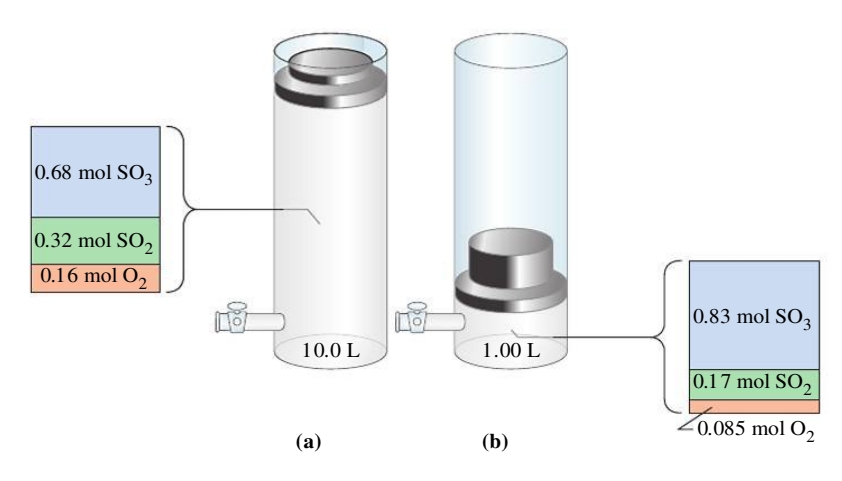
נרצה לדעת כיצד כמויות הגזים ישתנו כתוצאה מהקטנת/דחיסת הנפח של המערכת. כדי לעשות זאת נפתח את
לכן, אם, כמו באיור, נקטין את נפח המערכת פי
לכן, רק אם מספר המולים של
נשים לב ששלושה מולים של גז בצד השמאלי של התגובה יוצרים שני מולים של גז בצד הימני. באותו לחץ וטמפרטורה, שני מולים של
מסקנה:
כאשר הנפח של תערובת גזים בש”מ קטן, הלחץ יגדל והמערכת תזוז לכיוון שבו יש פחות מולים בכדי להפחית את הלחץ. כאשר הנפח גדל, המערכת תזוז לכיוון שבו יש יותר מולים בכדי להעלות את הלחץ.